エビデンス紹介
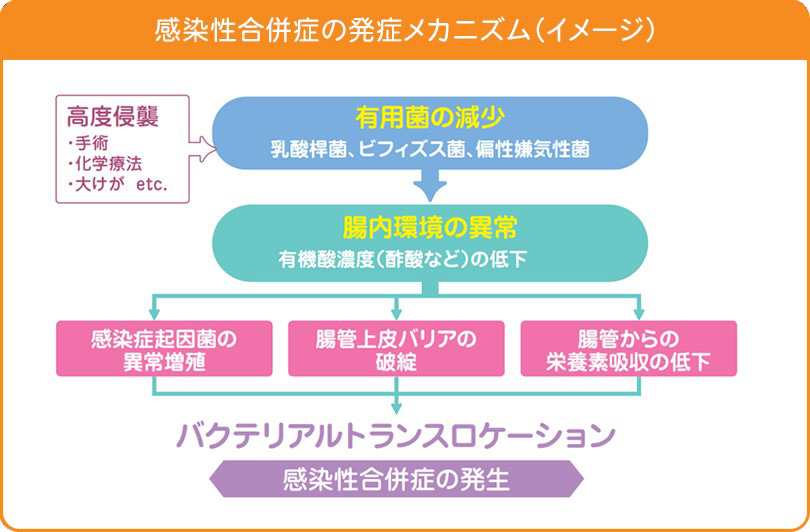
腸内細菌叢と感染性合併症の関係
腸内にはおよそ1000種類、約100兆個もの細菌がすみついています。また、腸内細菌が産生する有機酸(特に、酢酸、プロピオン酸、酪酸などの短鎖脂肪酸)は腸管上皮細胞のエネルギー源として利用されるほか、腸管上皮バリア機能を増強することが知られています。さらに、腸内の環境が弱酸性になることにより、有害な菌の増殖が抑制されることなどから、短鎖脂肪酸は腸内環境の指標として重要です。
しかし、患者に手術や化学療法などの強い侵襲が加わると、腸内細菌叢や腸内環境は大きく乱れ、その結果腸管上皮バリア機能が破綻してしまい、生きた腸内細菌が体内に移行する、いわゆるバクテリアルトランスロケーションが生じてしまいます。我々の研究でも、感染性合併症の発生にはバクテリアルトランスロケーションが深くかかわっていることを明らかにしています1)。
- 1)Yokoyama Y et al. Br J Surg 101: 189-199 (2014).
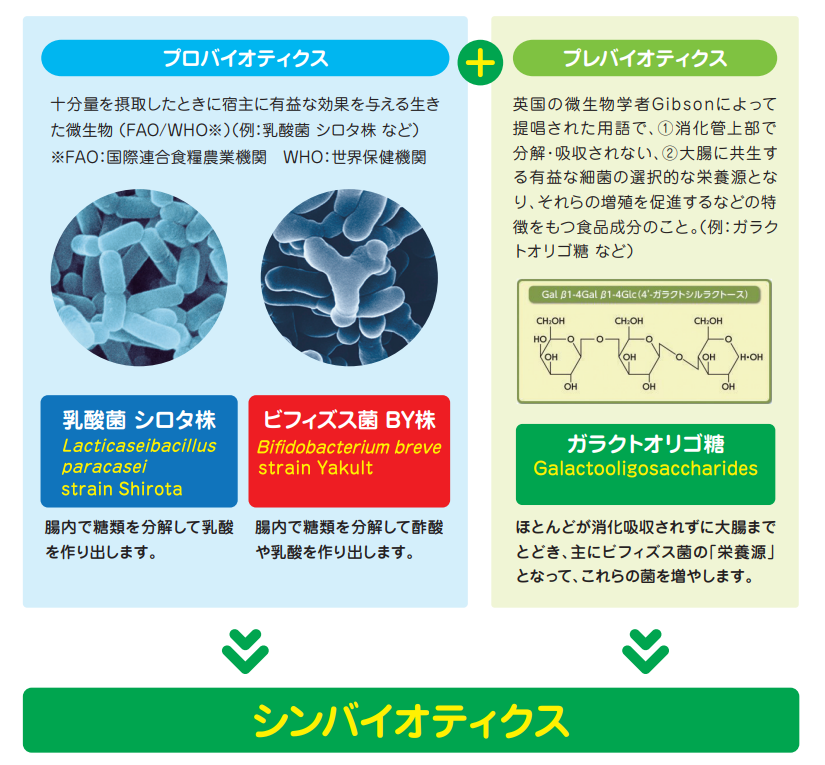
シンバイオティクスとは?
シンバイオティクスとは、「十分量を摂取したときに宿主に有益な効果を与える生きた微生物」であるプロバイオティクス2)3)と、「腸内有用菌の増殖を促して腸内細菌叢を改善・維持し、ヒトの健康の維持増進に役立つ難消化性の食品成分(食物繊維やオリゴ糖など)」であるプレバイオティクスを組み合わせたものです4)。その概念は1995年にGibson らにより提唱されました4)。プロバイオティクスあるいはプレバイオティクス単独よりも、シンバイオティクスとして摂取した方がより強い効果が期待できると考えられており、近年の臨床研究において多くのエビデンスが報告されています。
- 2)Fuller R. J Appl Bacteriol 66: 365-378 (1989).
- 3)Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food (2002).
- 4)Gibson GR, Roberfroid MB: J Nutr 125: 1401-1412 (1995).
(1)消化器外科領域への応用
Kanazawaら5)は、胆道がんの患者44例において、シンバイオティクス投与群(21名)と非投与群(23名)における術後感染性合併症の予防効果を無作為化比較試験にて検討しています。この試験では、シンバイオティクス投与群では、手術の翌日から14日間投与されました。その結果、非投与群では術後の乳酸菌やビフィズス菌などの腸内有用菌の菌数が急激に減少しましたが、投与群では増加しました。また、術後の感染性合併症の起因菌となりうる大腸菌群や緑膿菌、カンジダなどの菌数がシンバイオティクス投与群では非投与群に比べて低く抑えられていました。さらに、腸内環境の指標となる腸内の有機酸濃度もシンバイオティクス投与群では上昇していました。
このときの術後感染性合併症の発生率は、非投与群では52%であったのに対して、投与群では19%と有意に低値を示しました。
その後、Sugawaraら6)は、胆道がん患者へ術前から術後にかけてシンバイオティクスを投与(41名)することにより、術後のみ投与(40名)した場合に比べ、術後の腸内細菌叢や腸内環境の乱れに対する改善作用および感染性合併症に対する予防効果がより高まることが明らかとなりました。
- 5)Kanazawa H et al. Langenbeck's Arch Surg 390: 104-113 (2005).
- 6)Sugawara G et al. Ann Surg 244: 706-714 (2006).
(2)救命救急やがん化学療法への応用
高度な侵襲(外傷、熱傷、感染症など)によって全身性炎症反応症候群(Systemic Inflammatory Response Syndrome、SIRS)となった患者では、腸管上皮バリア機能の破綻による腸内有害菌のバクテリアルトランスロケーションから、重篤な感染性合併症の発症が危惧されています。実際、SIRS患者の腸内細菌叢や腸内環境を調べてみると、ビフィズス菌や乳酸菌など有用菌の顕著な減少や、短鎖脂肪酸濃度(特に酢酸や酪酸濃度の低下)が著しく低下していることがShimizuら7)によって明らかとなっています。さらに、Shimizuら8)によるSIRS患者に対するシンバオイティクスの有用性に関する研究では、シンバイオティクスの投与により、非投与群で認められた腸内のビフィズス菌、乳酸菌の減少や、短鎖脂肪酸濃度の低下は見られず、健常者とほぼ同様の状態であったことが認められました。また、腸炎、肺炎、菌血症といった感染性合併症が有意に減少することも示されました。
術前化学療法(DCF療法:ドセタキセル + シスプラチン + 5-FU)で治療を受けた進行食道がん患者を対象とした試験9)では、シンバイオティクス投与群では対照群に比べ、化学療法によって生じる腸内細菌叢や腸内環境の乱れが改善され、発熱性好中球減少症や重篤な下痢といった有害事象が軽減されることが明らかになりました。
- 7)Shimizu K et al. J Trauma 60: 126-133 (2006).
- 8)Shimizu K et al. Dig Dis Sci 54: 1071-1078 (2009).
- 9)Motoori M et al. Clin Nutr 36: 93-99 (2017).
(3)新生児・乳児への応用
低出生体重児は免疫機能や消化管機能などが未熟であり、感染症や発達が遅れるなどのリスクが生じます。また、低出生体重児では正常体重児と比べ、腸内ビフィズス菌の定着が遅れることが、これまでの研究で示されています。したがって、生後早期の腸内細菌叢をコントロールすることが患児の重症感染症の予防や栄養状態の改善に重要です。Kitajimaら10)は、極低出生体重児に対しプロバイオティクス(ビフィズス菌 B.ブレーベ・ヤクルト株)の投与による成長促進効果を認めています。さらに、Oshiroら11)による同菌株を極低出生体重児に用いた無作為化プラセボ対照二重盲検試験においても、同様に体重増加が示されました。
また、小児外科領域では、7名の長期入院中の短腸症候群患児に対してシンバイオティクスを継続的に投与したところ12)、腸内細菌叢の改善効果が認められ、さらに患児の体重増加が顕著となったことから、シンバイオティクス投与による腸管機能の改善が示唆されました。
- 10)Kitajima H et al. Arch Dis Child 76:F101-107(1997)
- 11)Oshiro T et al. Biomed Hub 4:502935(2019)
- 12)Kanamori Y et al. J Pediatr Surg, 39:1686-1692 (2004)

